Nature Chemistry | 揭示糖基化对天然产物生物合成酶催化活性的分子调控机制
2023-07-18 15:26:10 来源:中国科学院深圳先进技术研究院2023年6月26日,中国科学院深圳先进技术研究院合成生物学研究所周佳海课题组与合作团队在Nature Chemistry(《自然•化学》)在线发表题为“Tandem intermolecular [4+2] cycloadditions are catalyzed by glycosylated enzymes for natural product biosynthesis”(糖基化酶催化串联分子间[4+2]环加成反应用于天然产物的生物合成)的研究论文,报道了蛋白糖基化调控酶催化活性的新机制并发现了首例串联4+2环化酶。

蛋白质的糖基化修饰普遍存在于真核生物细胞中。糖基化会影响蛋白质正确折叠、分泌、亚基的聚合和信号转导等,从而在很多生物过程中发挥重要作用。然而,目前关于糖基化对生物合成酶催化功能的影响还不清楚。
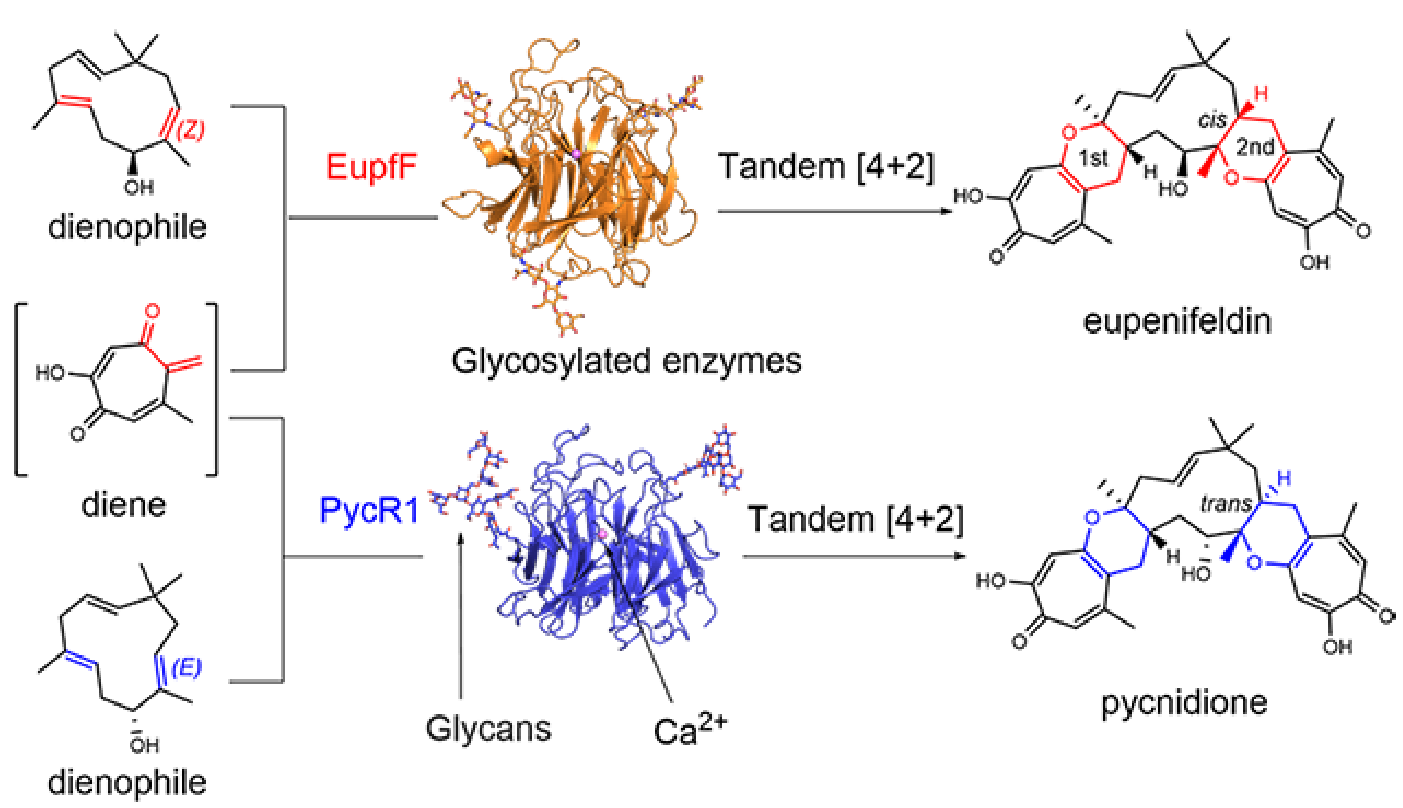
在这项研究中,作者首次揭示了糖基化对天然产物生物合成酶催化活性的分子调控机制。该论文报道了糖基化蛋白EupfF及其同源蛋白PycR1分别催化串联[4+2]环化反应,参与强效抗肿瘤天然产物eupenifeldin和pycnidione的生物合成。这两个分子是分别由制药公司百时美施宝和默克从真菌中发现的纳摩尔级抗肿瘤天然产物,因其复杂的化学结构和连续的手性中心,使其化学全合成一直未被攻破。在前期工作中,研究团队利用大肠杆菌表达的非糖基化蛋白EupF实现了eupenifeldin生源前体neosetophomone B的生物合成(JACS, 2019)。但是该非糖基化蛋白仅能实现单次[4+2]环化反应,且催化效率较低,始终无法合成结构更复杂的eupenifeldin及其类似物。为了解决这一问题,研究团队利用真核表达系统实现了EupfF及同源蛋白PycR1的异源表达,并通过生物信息学分析、底物饲喂、绿色荧光蛋白标记亚细胞定位、蛋白质谱、过典酸雪夫染色和体外生化实验等,确定了EupfF和PycR1是糖基化修饰的蛋白,并且呈现钙离子依赖性。它们均可催化罕见的串联[4+2]环化反应。为了研究糖基化对蛋白催化功能的影响,研究团队通过高分辨的蛋白-底物复合物晶体结构、量子力学计算模拟以及点突变实验确定了酶的完整催化机理,并发现糖基化调控酶催化活性的新机制。具体而言,糖基化显著提升蛋白对催化中心钙离子的亲和性,而钙离子既有催化作用又有重要的结构性作用,二者协同调控酶的催化中心,极大提高酶的催化效率。同时,利用真核异源表达系统实现了eupenifeldin和pycnidione的生物合成,为这两个资源有限的活性分子的成药性研究提供了物质保障。
该研究揭示了翻译后修饰对生物合成酶催化功能的显著影响。发现糖基化修饰的生物合成酶不但易于分泌,而且具有更强更完整的催化功能,这为生物合成酶的设计与改造提供了新的思路;而串联4+2环化酶的发现和催化机制的阐明为复杂药用天然产物的酶法合成带来新的启示。
- • 断碳水、吃益生菌有用吗?权威指南教你减肥 2025-01-16
- • 有人“天然短睡眠”却无碍健康,科学家发现七个突变基因 2025-01-16
- • 近视眼不会变老花眼,是“误会”吗? 2025-01-16
- • 国内首个医疗大模型应用检测验证中心成立 2025-01-16
- 网友评论:
- 已有0条评论
②本网转载并注明自其它来源的作品或会员自行上传的资料,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
③如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。


 搜索
搜索




